반응형
바이오 신약 개발 회사에 몸담고 있는 N년차 박사가 들려주는 신약 개발 이야기 9.
임상 2상이란?
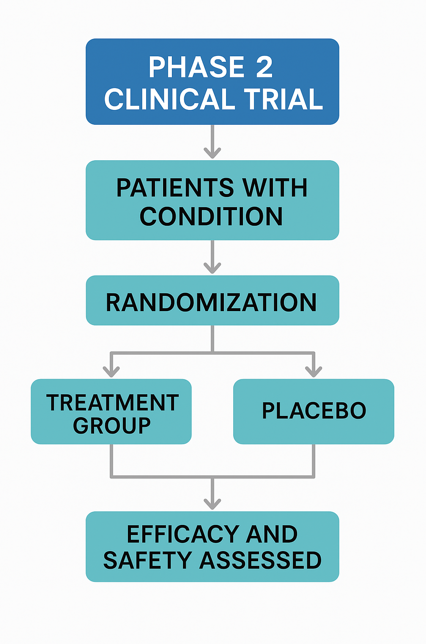
임상 2상(Phase 2 Clinical Trial)은 신약 후보가 사람에게 치료 효과를 낼 수 있는지를 본격적으로 검증하는 단계다.
1상에서 안전성이 확인된 약물을 실제 환자에게 투여해 효능(Efficacy)과 안전성(Safety)을 동시에 평가한다.
이 단계는 신약 개발에서 가장 결정적인 분기점 중 하나로, 효과가 없거나 부작용이 과도한 경우 이 단계에서 탈락하게 된다.
임상 2상의 목표
- 약물이 해당 질병에 효과가 있는가?
- 얼마나 많은 환자에게 효과를 보이는가? (반응률)
- 효과를 보는 데 적절한 용량은 무엇인가? (용량-반응 관계)
- 부작용은 어떤 양상으로, 어느 정도 발생하는가?
임상 2상은 이런 질문에 정량적 데이터로 답을 제시해야 하는 실험적 관문이다.
참여 대상과 규모
- 대상: 실제 질환을 가진 환자들
- 규모: 일반적으로 100~300명 내외
- 설계:
- 이중맹검(Double-blind): 피험자와 연구자 모두 투약 여부를 모르게 설계
- 무작위 배정(Randomized): 실험군과 대조군을 무작위로 배정
- 위약 대조(Placebo-controlled) 또는 기존 치료제 비교(Active comparator)
임상 2상의 유형
✔️ 2a상: 탐색적 임상 (Exploratory Phase 2)
- 효능 신호 탐지, 용량 범위 설정이 주요 목표
- 제한된 환자 수를 대상으로 약효가 있는지, 초기 지표를 확인
✔️ 2b상: 확증적 임상 (Confirmatory Phase 2)
- 용량-반응 곡선을 그리거나, 치료 효과와 통계적 유의성을 도출
- 임상 3상 설계의 기반이 되는 결정적 데이터 확보 목적
평가 지표
- 주평가변수(Primary Endpoint):
– 약물의 주된 효과를 입증할 핵심 지표
– 예: 종양 크기 변화, 염증 수치 감소, 혈압 변화 등 - 부평가변수(Secondary Endpoint):
– 부수적인 효능 또는 삶의 질 개선 정도, 기능성 변화 등 - 안전성 지표(Safety Endpoint):
– 부작용 발생 빈도, 심각도, 중단 사례 등을 추적
실패율이 가장 높은 단계
임상 2상은 임상시험 중 실패율이 가장 높은 단계(약 70% 실패)로 알려져 있다.
그 이유는 다음과 같다:
- 전임상/1상에서 예측된 약효가 실제 사람에게는 작용하지 않음
- 부작용이 의외로 심각하거나, 기대보다 약효가 약함
- 치료 효과가 있어도 통계적 유의성이 부족하거나 시장성 부족
따라서 2상을 성공적으로 통과하면, 신약의 가치가 급격히 상승한다.
최신 전략
✔️ 바이오마커 기반 환자 선별
- 특정 유전자 돌연변이, 단백질 발현 등을 기반으로 반응 가능성이 높은 환자군만 선별
- 임상 성공률을 높이고 부작용 리스크를 줄이는 정밀의학 전략
✔️ 적응형 설계 (Adaptive Design)
- 중간 결과를 분석해 군 수 조정, 용량 변경, 중단 여부 판단
- 시간과 비용을 줄이면서 효율성을 높이는 설계 방식
✔️ Real-World Evidence 접목
- 임상시험 외 실제 의료 환경 데이터(RWD)를 보조 지표로 활용
- 장기 안전성과 환자 삶의 질 등 간접 지표 보강
결론
임상 2상은 신약이 정말로 효과가 있는지를 사람에게 처음으로 본격 검증하는 단계다.
안전성과 효능의 균형을 확인하고, 임상 3상의 설계 기준을 마련하는 가장 과학적이고 전략적인 시험 구간이다.
이 단계에서의 성공은 신약이 시장에 한 걸음 더 가까워졌음을 의미하며, 실패는 빠르게 전략을 수정하거나 중단하는 의사결정을 가능하게 해준다.
즉, 임상 2상은 희망과 현실이 교차하는 신약 개발의 승부처다.
반응형
'신약개발스토리' 카테고리의 다른 글
| FDA 등 규제기관과 승인 절차 (0) | 2025.05.25 |
|---|---|
| 임상 4상: 시판 후의 감시와 연구 (0) | 2025.05.25 |
| 임상 1상: 안전성 시험의 시작– 신약이 사람에게 처음 적용되는 순간 (2) | 2025.05.23 |
| 임상시험이란?– 신약이 사람에게 도달하기까지의 마지막 검증 단계 (4) | 2025.05.23 |
| 전임상 시험: 세포와 동물로 시작하다 (2) | 2025.05.16 |
